Avaliação de riscos como uma ferramenta de garantia de qualidade de processo
Resumo
O controle da contaminação ambiental é um componente crítico da fabricação farmacêutica estéril, e o gerenciamento de riscos é
necessário para garantir que as práticas de controle corretas sejam implementadas. O processo de Gerenciamento de Riscos é uma série de etapas, incluindo a avaliação de riscos, que permite uma compreensão mais profunda do ambiente de fabricação. A remoção, redução ou monitoramento de atividades associadas a um produto ou processo para mitigar riscos pode ser o resultado de tal avaliação. Esta avaliação de risco qualitativa pode ser transformada em uma avaliação quantitativa usando ferramentas e procedimentos modernos de análise de risco; essas ferramentas fornecem a justificativa totalmente documentada por trás do caminho escolhido.
O Conceito de Risco na Produção Farmacêutica
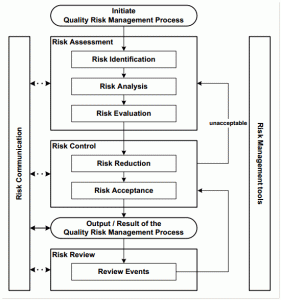
No rascunho divulgado do EU GMP Anexo 1, Revisão 12, a importância do gerenciamento de riscos (Risk Management) é destacada como uma ferramenta apropriada para garantir a qualidade de um processo. O rascunho é explícito sobre a necessidade de gerenciamento de risco para fabricantes de medicamentos estéreis e também recomenda amplamente o gerenciamento de risco para outros tipos de produtos, especialmente onde é necessário o controle de contaminação microbiana, por partículas e pirogênios (por exemplo, certos líquidos, cremes, pomadas, e intermediários bacterianos baixos) [1].
A produção e o uso de uma droga (remédio) e seus componentes envolvem necessariamente um certo grau de risco. É importante entender que a qualidade do produto deve ser mantida durante todo o ciclo de vida do produto. Isso garante que os atributos importantes para a qualidade do medicamento (Atributos Críticos de Qualidade) permaneçam consistentes durante as fases de desenvolvimento e produção do medicamento. De acordo com a ICH Q6A, a qualidade do medicamento refere-se à adequação de uma substância ou medicamento para o uso pretendido [5].
Em geral, um procedimento de gerenciamento de riscos se concentra na análise de cada processo no ciclo de vida de um produto com a intenção de realizar uma avaliação, mitigação e revisão dos riscos associados ao longo do tempo. Conforme definido no ICH Q9, a avaliação de risco é um processo sistemático de organização de informações para apoiar decisões de risco que são feitas como parte de um processo de gerenciamento de risco [2].
Ouça o arquivo de áudio aqui ou preencha o formulário para acessar o artigo completo.